网站首页健康养生 >正文
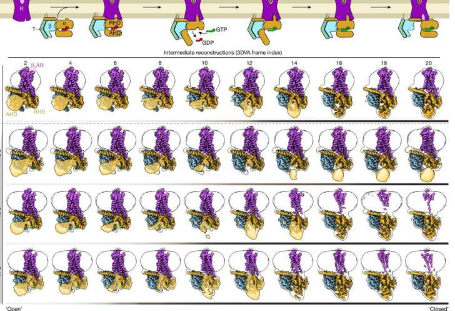
一个国际研究小组成功“拍摄”了一种重要受体的激活过程。他们在不同的时间点冷冻了相关分子,并在电子显微镜下拍摄了它们的照片。然后他们能够按顺序放置这些静止图像。该序列逐步显示受体被激活时所经历的空间变化。
埃尔兰根-纽伦堡弗里德里希-亚历山大大学 (FAU) 的研究人员对这项研究做出了重大贡献。研究结果现已发表在《自然》杂志上,从中期来看,可能会导致更有效药物的开发。
细胞通过信号分子相互通信,它们使用称为受体的特定接收结构检测信号分子。它们嵌入细胞膜中,即细胞周围的薄层。一组特别重要的受体称为 GPCR。
如果合适的信号分子附着在其外部,就会启动一系列复杂的反应。受体改变其空间结构,从而激活细胞内部附着于受体的 G 蛋白。这种蛋白质会移动,然后可以通过扩散的方式穿梭到细胞中的酶处,以调节该酶,或者它可以打开或关闭某些基因的转录。
“人类有超过 800 个 GPCR,每个 GPCR 都专门用于检测特定信号,”FAU 药物化学系主任 Peter Gmeiner 教授解释道。“在我们的研究中,我们专注于一种特殊的 GPCR——β2-肾上腺素能受体。它被肾上腺素激活,并参与心肺功能的调节等。”
因此,这也是开发治疗哮喘或心功能不全的药物的一个重要的可能起点。“然而,为了做到这一点,全面了解受体及其附着的 G 蛋白的激活非常重要,”Gmeiner 解释道。
现已发表的结果可能会做出重大贡献。由Georgios Skiniotis(斯坦福大学)领导的国际团队,包括Brian Kobilka(斯坦福大学)、Peter Hildebrand(莱比锡大学和柏林夏里特大学)和Peter Gmeiner,成功地一步步分解了受体激活的过程。研究人员使用了一种称为时间分辨低温电子显微镜的特殊方法。由受体和 G 蛋白组成的复合物在激活后不久即在 -150 度下休克冷冻。
“在显微镜下,我们获得了一系列不同的框架,”格迈纳解释道。“不同的是,我们在显微镜下观察到的数千个分子从来都不是完全同步的。它们的自然流动性意味着一些分子在激活的稍早阶段被冻结,而另一些则在更高级的阶段被冻结。”
这种“冷冻冷冻”可以在激活后的不同时间重复。由此获得的图像使研究人员能够在原子水平上逐步重建该过程。
“在我们的工作中,我们主要关注药物附着到 β2 肾上腺素受体后引发的 G 蛋白空间结构的变化,”Gmeiner 解释道。他的团队为该项目的成功做出了重大贡献:他们成功地创造了一种与 β2 受体结合特别好的“超级肾上腺素”。
“这种牢固的结合可以稳定由受体和 G 蛋白组成的复合物,”FAU 的科学家解释道。通常,这项任务是由称为衔接蛋白的蛋白质负责的。它们的作用就像分子口香糖一样,将复合物结合在一起。
“然而,它们的工作做得非常好,以至于在低温电子显微镜下看不到任何中间步骤,”格迈纳解释道。由于他的“超级肾上腺素”,研究人员能够在没有衔接蛋白的情况下完成任务。没有它们,受体-G 蛋白复合物就足够稳定。
“只有这样我们才能让这场运动变得可见,”格迈纳补充道。
这些结果可能会促进新药物的开发,而不仅仅是那些对 β2 肾上腺素能受体有影响的药物。GPCR 被认为在对抗疾病方面发挥着核心作用。当今批准的药物中几乎有三分之一会影响这些受体的功能,例如通过加强或削弱向细胞的信号传输。Gmeiner 希望,时间分辨低温电子显微镜应该可以更容易地开发针对特定需求的特别有效的药物,从而减少副作用。
为此,研究人员必须完全了解受体及其 G 蛋白的分子过程,这一点至关重要。参与当前项目的研究人员之一布赖恩·科比尔卡(Brian Kobilka)几年前获得的诺贝尔奖表明了这一点的重要性。他是第一个使用 X 射线晶体学在原子尺度和三种不同状态下确定 GPCR 三维结构的人。这些实验中还使用了 Peter Gmeiner 实验室开发的定制药物。
版权说明:本站所有作品图文均由用户自行上传分享,仅供网友学习交流。若您的权利被侵害,请联系我们
相关文章:
- 2024-03-14概念验证研究展示了如何在牛奶中生产人胰岛素
- 2024-03-14揭开生命的起源科学家发现太空中冷糖酸的形成
- 2024-03-13研究人员开发了工程酿酒酵母菌株用于优化类胡萝卜素的生产
- 2024-03-13GPS纳米粒子平台精确地将治疗有效载荷传递给癌细胞
- 2024-03-13研究基因功能的虚拟工具旨在减少用于基因测试的动物数量
- 2024-03-13人工智能在海洋数据收集领域掀起波澜
- 2024-03-13探索胞质外功能开关在细菌物种间的可转移性
- 2024-03-13有机生姜对高位隧道繁殖施肥的反应
- 2024-03-12灵活的人工智能光电传感器为独立节能健康监测设备铺平了道路
- 站长推荐
- 栏目推荐
