网站首页健康养生 >正文
在植物和动物中,携带遗传信息的DNA的基本包装单位是所谓的核小体。核小体由缠绕在八种称为组蛋白的蛋白质周围的DNA片段组成。
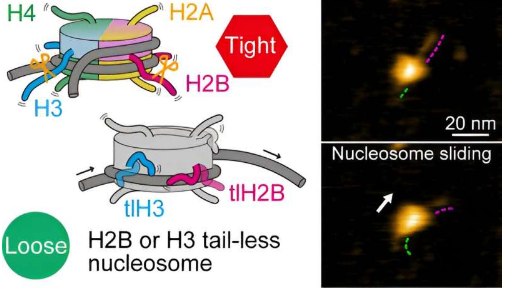
在基因表达(蛋白质产生的基础过程)过程中,核小体参与各种动态结构变化,例如核小体滑动、DNA解包和其他DNA-组蛋白相互作用。在这些过程中特别重要的是组蛋白的末端结构或尾部。
组蛋白尾部经过化学修饰,根据需要改变组蛋白的功能。核小体动力学的详细研究,尤其是可视化对于更好地理解组蛋白尾部的作用至关重要。
金泽大学的MikihiroShibata及其同事现已成功录制无尾核小体的视频,表明组蛋白尾部的缺失显着增加了核小体的动态活性。该研究发表在《纳米快报》上。
科学家们使用了高速原子力显微镜(HS-AFM),这是一种强大的纳米成像工具,可以在高空间和时间分辨率下可视化分子结构及其动力学。
为此,需要将核小体放置在基底上。Shibata及其同事使用所谓的柱[5]芳烃(具有五边形管状结构的分子)薄膜作为基底,形成理想的表面,因为核小体很容易吸附在其上,而不会抑制动力学过程。
研究人员首先观察了所有八种组蛋白都缺乏尾巴的核小体。根据HS-AFM观察,他们得出结论,核小体滑动和DNA解包/重包比正常(规范)核小体更频繁地发生。这表明,如果没有尾部,组蛋白-DNA相互作用就会减弱,从而导致DNA更容易与组蛋白分离。
为了更好地了解特定组蛋白尾部的作用,Shibata和同事制备了一种组蛋白无尾部的核小体。有四种不同类型的组蛋白,称为H2A、H2B、H3和H4。对核小体的HS-AFM实验表明,H2B和H3无尾核小体表现出动态频率增加。相反,这意味着典型的H2B和H3组蛋白对于核小体稳定性至关重要。
科学家们指出,他们无法观察到组蛋白尾部的任何实际运动——很可能该研究的时间分辨率为0.3秒,比尾部包裹/展开动力学的速率慢得多。尽管存在这种限制,Shibata及其同事的工作清楚地证明了H2B和H3组蛋白的尾部是核小体动力学的主要贡献者。
关于未来的工作,研究人员援引研究人员的话说,“一种标记组蛋白尾尖的技术可能使HS-AFM能够捕获组蛋白尾部本身的运动。”
原子力显微镜(AFM)的一般原理是用一个非常小的尖端扫描样品的表面。在水平(xy)扫描过程中,连接到小悬臂的尖端跟随样品的垂直(z)轮廓,在悬臂上产生可测量的力。
xy位置处的力的大小可以与z值相关;扫描过程中生成的xyz数据会生成高度图,提供有关所研究样本的结构信息。在高速原子力显微镜(HS-AFM)中,工作原理稍微复杂一些:使悬臂在其共振频率附近振荡。
当针尖绕表面移动时,会记录悬臂振荡幅度(或频率)的变化(由针尖与样品表面的相互作用引起),因为这些变化提供了局部z值的测量。AFM不涉及透镜,因此其分辨率不受X射线衍射等所谓衍射极限的限制。
HS-AFM生成视频,其中帧之间的时间间隔取决于生成单个图像的速度(通过xy扫描样本)。
金泽大学纳米生命科学研究所(WPI-NanoLSI)的研究人员近年来进一步开发了HS-AFM,使其可以应用于实时研究生化分子和生物分子过程。MikihiroShibata及其同事现在已经应用该方法详细研究核小体动力学,特别是组蛋白分子末端的作用,组蛋白是在DNA可及性中发挥关键作用的蛋白质。
版权说明:本站所有作品图文均由用户自行上传分享,仅供网友学习交流。若您的权利被侵害,请联系我们
相关文章:
- 2024-05-11花椰菜的遗传学研究揭示了其进化历史
- 2024-05-11为什么进化往往有利于小动物和其他生物
- 2024-05-11揭示与尖孢镰刀菌初始感染有关的关键毒力milRNA。sp。库本塞
- 2024-05-11研究为肝脏再生带来希望
- 2024-05-11具有纯电磁相互作用的最小和最重的原子
- 2024-05-10研究发现20世纪养猪业的变化导致耐抗生素沙门氏菌在世界范围内传播
- 2024-05-10新的根瘤菌硅藻共生解决了长期存在的海洋之谜
- 2024-05-10净零计划显示残余排放的气候雄心有限
- 2024-05-10变废为宝探索PET塑料升级回收的生物和非生物方法
- 站长推荐
- 栏目推荐
