网站首页健康养生 >正文
当生物细胞暴露在过高的温度下时,会经历一个称为“热应激反应”的过程。热应激触发一系列信号传导机制,产生多种热休克蛋白(Hsps),包括小热休克蛋白(sHsps)。这些“细胞消防员”保护热敏感结构,防止蛋白质结块,并帮助重新折叠受损的蛋白质。
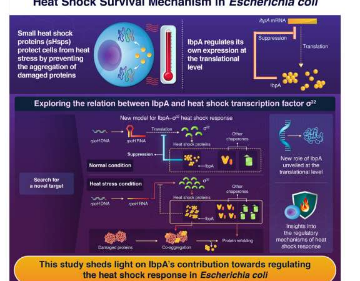
在大肠杆菌(一种被广泛研究的细菌)中,一种名为IbpA的sHsp具有有趣的附加用途。除了作为伴侣的传统作用外,IbpA还充当“安全锁”,在不需要时抑制其自身的合成。简而言之,IbpA可以通过影响特定基因从信使RNA到蛋白质的翻译来调节特定基因的表达,以响应温度提示。
尽管科学家最近发现IbpA调节其自身及其旁系同源物(具有共同祖先并由基因复制事件产生的基因)IbpB的表达,但仍不清楚该蛋白是否也调节其他基因。
在最近发表在《美国国家科学院院刊》上的一项研究中,日本东京工业大学(TokyoTech)的HidekiTaguchi教授和TsukumiMiwa博士解决了这一知识差距。两人通过基因工程大肠杆菌菌株的各种实验探索了IbpA调节热休克反应的机制,揭示了Hsp的新关键功能。
他们最初发现IbpA的过度表达导致许多Hsp的显着下调。进一步的实验表明,IbpA在翻译水平上对这些Hsp没有影响,即它不会阻止从RNA合成这些蛋白质。这使得研究人员推测IbpA可能会影响σ32的表达,σ32是一种主要的热休克转录因子,负责调节大约一百个基因的表达,其中许多基因与热休克反应有关。
通过涉及IbpA过表达和IbpA缺失突变体的实验,研究人员发现IbpA在翻译而非转录水平抑制σ32的表达。因此,他们提出了一个新模型来解释IbpA在正常和热应激条件下如何运作。在此模型中,当温度不太高时,IbpA会抑制rpoHRNA的翻译,从而产生σ32。反过来,σ32的缺乏使Hsps(包括IbpA)水平保持较低水平。然而,当发生热休克时,IbpA会与错误折叠或聚集的蛋白质结合,而仅留下rpoHRNA。这导致σ32的量迅速增加,从而激活Hsps的产生来应对由热应激。
然而,这些结果引出了一个问题:IbpA抑制rpoH翻译的生理意义是什么?“一种可能性是翻译水平的表达调节通常是快速的,因此非常适合热休克后立即诱导,”田口教授解释道。“正常条件下IbpA严格抑制σ32水平的另一个优点是抑制Hsp表达,这在没有压力的情况下是不必要的。”
总的来说,这项研究有助于阐明细菌物种如何适应恶劣环境。田口教授评论道:“我们针对IbpA的研究为这一先前未被认识的因素在大肠杆菌热休克反应中的参与提供了新的线索。”这些知识在生物工程、工业、医疗和环境应用中可能至关重要。
版权说明:本站所有作品图文均由用户自行上传分享,仅供网友学习交流。若您的权利被侵害,请联系我们
相关文章:
- 2023-11-26贻贝组织和足丝之间的动态生物界面在快速释放中发挥重要作用
- 2023-11-24研究人员采用新的人工智能方法来分析肿瘤
- 2023-11-24干细胞研究为骨骼肌再生铺平道路
- 2023-11-24使用人工智能了解健康的老年人如何在家中度过老年
- 2023-11-24研究表明植物利用空气通道产生定向光信号并调节向光性
- 2023-11-24科学家们最终通过溶解生长过程中的结构缺陷成功在实验室中生长白云石
- 2023-11-24荷兰退休人员帮助解开蝙蝠阴茎异常大之谜
- 2023-11-23这条海虫的后部游走了现在科学家知道了它是如何做到的
- 2023-11-23以人工智能为指导更好地制造钙钛矿太阳能电池
- 2023-11-23从废煤中提取碳纤维
- 站长推荐
- 栏目推荐
- 阅读排行
- 健康和教育密切相关新西兰需要将其更多地融入小学
- Steam现已全面支持DualShock和DualSense控制器无需购买新的Xbox控制器
- DistrictTaco希望扩大其在罗利地区的业务
- Humane的AiPin–您的新型可穿戴人工智能助手
- Microsoft365CopilotAI如何提高您的工作效率
- MicrosoftRadius云开源应用程序平台
- 生产目的FiskerPear具有透明A柱因为移动头部太困难
- 索尼Xperia5V马来西亚发布Snapdragon8Gen2SoC 8GBRAM 256GB储存空间起价RM4999
- Nissan的模块化PulsarSportbak集轿跑车 旅行车和皮卡于一体
- 新奥尔良烤肉店将在中央市场推出
