网站首页健康养生 >正文
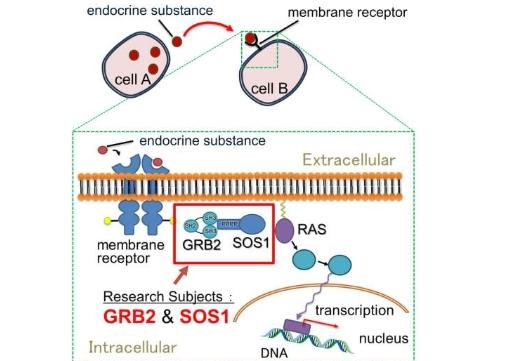
东京都立大学的研究人员对细胞中的蛋白质GRB2和SOS1如何将信号从膜受体传递到细胞核有了新的认识。
他们利用核磁共振(NMR)研究了GRB2和SOS1的哪些特定区域如何相互结合,以及它们如何触发液-液相分离(LLPS)。信号转导问题是癌症的主要原因:了解其工作原理可能会带来全新的治疗方法。
生物细胞通过复杂的信号通路网络工作,其中细胞特定部位的反应通过蛋白质的结构变化依次引导其他部位,这是一个巨大的生物分子接力,其中“接力棒”通过一系列蛋白质的相互结合和修改而传递。
这种“信号转导”过程是细胞健康功能的关键;编码这些信号传递蛋白质的基因突变是许多肿瘤和癌症的起因。
在寻找新的治疗和预防方法的过程中,科学家们致力于了解传递的工作原理以及整个过程的调节方式。
由东京都立大学副教授TeppeiIkeya领导的研究小组一直在研究GRB2和SOS1所起的作用,这两种蛋白质已知在将信息从某些膜受体传递到RAS蛋白的过程中发挥着重要作用,而RAS蛋白本身则是将信号传递到DNA所在的细胞核的关键因素。
这最终导致细胞能够利用原始信号来调节更多蛋白质的产生。然而,这一途径的具体运作方式尚未完全了解。
造成这种情况的原因在于GRB2和SOS1的柔软性或“松软性”,使得它们难以用X射线晶体学和低温透射电子显微镜等工具进行研究。
现在,该团队利用核磁共振(NMR)技术和尖端统计工具来揭示有关GRB2和SOS1如何参与信号转导的新细节。
已知GRB2具有三个结构域(NSH3、SH2、CSH3),其中两个SH3结构域(NSH3、CSH3)与SOS1蛋白结合。虽然长期以来人们认为它们与SOS1的结合强度相同,但研究小组发现NSH3对SOS1的亲和力比CSH3高10到20倍。不仅如此,他们还发现了它们动力学方面的关键差异;CSH3表现出独立于其他结构域的自由移动性。
由此产生的图像比以前对RAS信号转导的任何想象都要详细得多。它还与最近的研究有关,该研究表明GRB2和SOS1参与液-液相分离(LLPS),它们在细胞中形成致密液滴并调节信号传递给RAS的强度。
在该团队的新机制中,SOS1粘附在SH3结构域上的部分由于具有强亲和力,能够结合多个NSH3结构域,而灵活的CSH3结构域则可以吸引其他自由的SOS1分子。
这导致GRB1蛋白充当桥梁的作用,通向富含GRB2和SOS1的大型柔性结构域。这是首次提出GRB2和SOS1的LLPS机制。
这种前所未有的详细程度为细胞信号传导的工作原理提供了新的见解,并可能帮助我们了解当细胞信号传导无法正常运作时,病理是如何发生的。该团队希望他们的发现不仅能启发新的研究,还能启发新的癌症治疗方法。
版权说明:本站所有作品图文均由用户自行上传分享,仅供网友学习交流。若您的权利被侵害,请联系我们
相关文章:
- 2024-10-29科学家开发新方法分析实验室制造的光合天线的三维结构
- 2024-10-29研究人员提出用于miRNA检测的新型生物传感器
- 2024-10-29下一代栽培香蕉目录
- 2024-10-29研究具有非单调S形流变性的流体流动
- 2024-10-29在疟原虫中发现关键的铁转运蛋白可能会带来更快起效的药物
- 2024-10-28lncRNA在人类中发挥的神经发育作用已得到证实可能影响自闭症和癫痫
- 2024-10-28罗氏与Dyno启动价值10亿美元以上的AAV基因治疗载体合作
- 2024-10-26研究表明细菌病原体必须在呼吸道定植和产生抗生素耐受性之间取得平衡
- 2024-10-26新发现的缓步动物物种的分子研究有助于解释承受高剂量辐射的能力
- 站长推荐
- 栏目推荐
