网站首页健康养生 >正文
疟疾的症状发生在感染的血液阶段,此时寄生虫侵入人体红细胞并在其中复制。PfPCRCR复合物1包含PfRH5(参考文献2、3)、PfCyRPA、PfRIPR、PfCSS和PfPTRAMP,对于最致命的人类疟原虫恶性疟原虫侵入红细胞至关重要。针对这些保守蛋白中的每一种的抗体3、4、5、6或纳米抗体1都可以预防侵袭,使它们成为主要的血液阶段疟疾疫苗候选者。然而,人们对PfPCRCR在入侵过程中如何发挥作用知之甚少。在这里,我们展示了通过低温电子显微镜测定的PfRCR复合物7、8的结构,其中包含PfRH5、PfCyRPA和PfRIPR。我们测试了PfRH5打开插入膜的假设9,结果表明刚性的、二硫键锁定的PfRH5可以介导有效的红细胞侵袭。我们通过建模和红细胞结合测定表明,PfCyRPA结合抗体5通过空间机制中和入侵。我们确定了PfRIPR的结构,表明它由灵活连接到细长尾部的有序多域核心组成。我们还表明,作为生长中和抗体6靶标的PfRIPR的延长尾部与寄生虫膜上的PfCSS-PfPTRAMP复合物结合。因此,模块化PfRIPR通过细长的尾部与裂殖子膜相连,其结构核心呈现PfCyRPA和PfRH5与红细胞受体相互作用。这为红细胞侵袭的分子机制提供了新的见解,并为合理疫苗设计的新方法开辟了道路。
恶性疟原虫对红细胞的入侵涉及一系列严格有序的事件,从寄生虫的裂殖子形式接触红细胞时开始10,11。随后,红细胞表面发生强烈的肌动蛋白依赖性变形,裂殖子重新定向,将其顶极置于红细胞膜附近。顶端细胞器的放电释放了入侵所需的机制,包括PfRCR复合体。这导致裂殖子-红细胞接触部位的钙峰值以及裂殖子和红细胞之间移动连接的形成。然后寄生虫主动进入红细胞内部,紧接着受感染的红细胞发生一系列变形,寄生虫在液泡内建立。
红细胞入侵的这些阶段需要多种宿主-寄生虫相互作用,其中许多是由具有冗余功能的蛋白质家族介导的10。然而,当PfRH5(参考文献12、13)和含有红细胞受体basigin14、15的膜复合物之间的相互作用被阻止时,尚未发现恶性疟原虫菌株能够侵入红细胞。事实上,PfRH5和basigin都是侵袭中和抗体的靶标4、14、16、17,并且PfRH5免疫在疟疾Aotus模型中具有保护作用12并在人类攻击模型中延迟症状的发作13。PfRH5与PfCyRPA和PfRIPR组装形成三联PfRCR复合物7,8,18。PfCyRPA和PfRIPR对于红细胞侵袭也是必需的,并且是侵袭阻断抗体的靶标5,6,7,19,20,21。最近,含有两种裂殖子表面蛋白PfCSS和PfPTRAMP的复合物已被证明可以与PfRCR结合,并且确定了PfCSS的结构1。RIPR、CSS和PTRAMP相互作用首先在诺氏疟原虫中发现,这些蛋白对于诺氏疟原虫的入侵也是必需的22。已鉴定出针对PfCSS和PfPTRAMP1的侵袭中和纳米抗体,并且PfPCRCR的所有五个成员都是血期疟疾疫苗的潜在成分。
尽管PfRCR复合体的每个成分都有重要功能,但它们在侵袭过程中的作用却是神秘的。阻断PfPCRCR任何成员的功能会在入侵过程中的同一步骤停止红细胞的入侵,从而防止寄生虫-红细胞界面处钙浓度的增加,这一事件被认为发生在移动连接形成之前1。已经提出了几种PfRH5功能模型,其中一种模型表明PfRH5和PfRIPR经历了实质性构象变化以插入红细胞膜,形成孔9,另一种模型表明PfRH5调节信号通路,导致入侵期间细胞骨架发生变化23。然而,这两个假设都没有得到强有力的支持。为了进一步了解PfRCR在侵袭中的作用,我们使用低温电子显微镜(cryo-EM)以3.0Å分辨率确定了其结构,并评估了PfRH5和PfRIPR在侵袭中的作用。
PfRCR复合物的结构
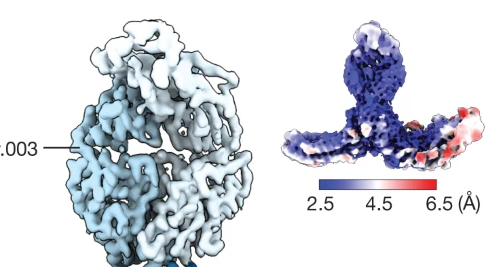
尽管PfRH5(参考文献3、4)和PfCyRPA5的晶体结构均可用,但PfRCR的结构信息仅限于复合物分辨率约为7Å的冷冻电镜图9。之前的研究并未实现更高的分辨率,因为PfRCR复合体在玻璃化时采用了首选方向,从而阻碍了均匀成像并降低了后续三维重建的分辨率。PfRH5和PfCyRPA的晶体结构可以对接到该图中,从而提供对PfRCR架构的深入了解,但这既不能产生有关PfRIPR结构的原子级信息,也不能产生PfRCR组分之间的相互作用。为了提供PfRCR的原子分辨率模型,我们评估了与PfRH5或PfCyRPA结合的单克隆抗体的Fab片段降低PfRCR采用首选方向的可能性的能力。与入侵中和抗PfCyRPA抗体Cy.003(参考文献5)的Fab片段结合的PfRCR复合物(扩展数据图1a、b)具有足够均匀的颗粒分布,可生成一致的冷冻电镜图全局分辨率为3.0Å(图1a,扩展数据图1c、d和2以及扩展数据表1)。
版权说明:本站所有作品图文均由用户自行上传分享,仅供网友学习交流。若您的权利被侵害,请联系我们
相关文章:
- 2023-12-27物理学家首次纠缠单个分子为量子科学带来新平台
- 2023-12-27用于体外培养和衍生猴多能干细胞的化学成分明确的无异源培养系统
- 2023-12-27NIST开发人类尿液标准以更准确地诊断肾脏疾病
- 2023-12-26开创性的可穿戴肾脏和其他以患者为中心的解决方案
- 2023-12-26禽流感已导致全球数百万海鸟死亡南极洲可能是下一个
- 2023-12-25NIH试验中抗体可减少多种食物的过敏反应
- 2023-12-25无法打嗝对日常生活有何影响
- 2023-12-25推进细胞和基因治疗工艺标准
- 2023-12-25分子手提钻通过振动摧毁癌细胞
- 站长推荐
- 栏目推荐
