网站首页生活常识 >正文
囊泡单胺转运蛋白 2 (VMAT2) 是中枢神经系统中唯一介导单胺类神经递质储存的转运蛋白。它在介导神经冲动传递和神经保护方面发挥着关键作用。
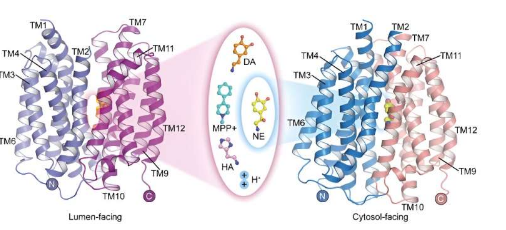
目前,VMAT2识别和运输几种结构不同的单胺类神经递质以及帕金森病诱导剂MPP +的机制尚不明确,质子偶联底物转运的分子机制也需要进一步探索。
5月22日,中国科学院生物物理研究所赵岩研究员领导的研究团队与中科院物理研究所蒋道华研究员合作,在《Cell Research》杂志上发表研究成果,报道了人类囊泡单胺转运体2(hVMAT2)在低pH下的载脂蛋白结构,囊泡面向多巴胺、去甲肾上腺素、组胺和神经毒素MPP +结合的复杂结构,以及去甲肾上腺素在面向胞质溶胶状态下结合的复杂结构。
这些结构揭示了VMAT2底物识别的结构基础,并进一步完善了质子偶联底物运输的分子机制。
虽然去甲肾上腺素、多巴胺、血清素和MPP +的分子结构各有不同,但VMAT2与这些底物结合的复杂结构表明它们都结合在转运蛋白的相似位置上。然而,这些底物某些功能基团的细微差异导致它们与转运蛋白的相互作用和结合方式存在显著而关键的差异。这些差异说明了VMAT2如何高效识别不同的底物分子。
研究人员报道了去甲肾上腺素以不同构象与 VMAT2 结合的结构,包括面向胞质溶胶和面向囊泡的构象。
尽管VMAT2 的构象发生了显著变化,但去甲肾上腺素的底物结合口袋在此过程中保持相对稳定,与周围残基的相互作用没有显著变化。这种巧妙的构象转变对于 VMAT2 的功能至关重要。
通过分析不同pH条件下VMAT2的结构,证实D33可能是另一个关键的质子化位点。
该工作通过深入分析VMAT2识别不同结构多样的单胺类神经递质和神经毒素的机制,提出了VMAT2构象变化的分子模型,并进一步细化了质子偶联底物转运的具体机制。
这些结果为全面认识VMAT2的运输方式提供了宝贵见解,丰富了主要促进剂超家族底物运输的知识体系,为药物研发和优化奠定了重要基础。
版权说明:本站所有作品图文均由用户自行上传分享,仅供网友学习交流。若您的权利被侵害,请联系我们
相关文章:
- 2024-05-30很难找到皮肤化石但一项罕见的发现揭示了从水到陆地进化的线索
- 2024-05-29小型鸟类凭借进化优势拥有多种飞行方式
- 2024-05-29科学家探索单原子催化剂如何影响高级氧化过程中的水净化
- 2024-05-29揭示促成神秘同步珊瑚产卵的关键因素
- 2024-05-29新的深度学习模型利用视频来测量胚胎发育
- 2024-05-29科学家让灵长类动物与脑容量较小的哺乳动物进行对比看看谁是最聪明的觅食者
- 2024-05-28相机标签捕捉南极小须鲸的社交灵活性
- 2024-05-28科学家进一步了解导致加勒比海和西非混乱的海藻
- 2024-05-28气候变化导致树木种群远离维持其生存的土壤真菌
- 站长推荐
- 栏目推荐
