网站首页生活常识 >正文
当现有技术的分辨率不够时,如何分析分子结构?杜塞尔多夫海因里希海涅大学(HHU)的物理学、化学和医学领域的研究人员结合并进一步开发了各种显微镜和光谱技术,以检查细胞膜中对“程序性细胞死亡”至关重要的蛋白质排列。
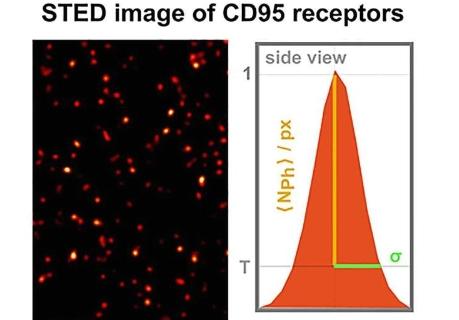
在《科学进展》杂志上发表的一篇文章中,他们描述了导致细胞死亡的CD95受体作出反应的情况。
在生物细胞中,绝大多数功能结构由蛋白质分子组成。为了了解蛋白质的功能,必须了解其三维结构。记录蛋白质的空间排列以及它们之间以及与周围和更广阔环境中其他蛋白质的动态相互作用也很重要,因为这些因素经常触发它们的功能。
获取这些信息非常复杂,而且这种测量在一定程度上已经达到了技术极限。由于相关的蛋白质结构通常只有1到100纳米(nm;十亿分之一米)的大小,因此无法使用传统光学显微镜进行分辨。
2014年荣获诺贝尔化学奖的“受激发射损耗显微镜”(简称:STED显微镜)等先进的高分辨率技术本身也还不够。
由CorneliaMonzel教授(实验医学物理研究所)和ClausAMSeidel教授(分子物理化学系主任)领导的研究小组现已结合各种技术,以了解细胞膜表面所谓的CD95受体的运作方式。目的是确定触发细胞信号所需的受体的完整分子排列和相互作用。
CD95受体对于细胞而言至关重要:最终导致受控或程序性细胞死亡(“细胞凋亡”)的信号是通过这种蛋白质发起的。
蒙泽尔教授是这项研究的两位通讯作者之一,他表示:“在日常生活中,这种信号通路确保了新细胞的产生和现有细胞的死亡数量相同,从而保证了我们不会不断生长。它在许多其他过程中也发挥着重要作用,如生物的发育、伤口愈合和癌症治疗。”
这种受体的尺寸只有约20纳米。这项研究的两位主要作者之一尼娜·巴特尔斯博士说:“由于我们无法使用高分辨率技术直接清晰地解析这些微小结构,因此我们必须进一步开发各种微观和光谱技术并将它们结合起来。”
除了可以解析40纳米以下结构的STED显微镜外,杜塞尔多夫的研究人员还进一步开发了所谓的Förster共振能量转移(FRET)图像光谱和光漂白步骤分析。因此,他们可以测量膜上受体的数量、分布和相互作用,精确到几纳米。
这项研究的第二位主要作者NicolaasvanderVoort博士说:“通过测量,我们能够开发出一个清晰的模型,说明哪些过程需要激活CD95受体,从而控制细胞死亡。要启动细胞死亡信号,细胞膜上所有CD95受体中只有15%需要以两三个的形式结合到另一种蛋白质上,即所谓的CD95配体。”
这项研究的另一位通讯作者塞德尔教授指出了这项研究成果更广泛的方面。“除了与激活受控细胞死亡有关的发现外,这项研究还描述了重要的微观和光谱学进展,这些进展可以转移到许多其他生物和医学问题上。”
版权说明:本站所有作品图文均由用户自行上传分享,仅供网友学习交流。若您的权利被侵害,请联系我们
相关文章:
- 2024-09-10为什么材料变形后会变得更强研究揭示了加工硬化的普遍机制
- 2024-09-10科学家们知道如何治疗一类狡猾的致病酶
- 2024-09-10人工智能提升室内食品生产的能源可持续性
- 2024-09-10化学变色龙揭示分离稀土金属的新途径
- 2024-09-10首款配备人造肌肉的机器人腿可灵活跳跃
- 2024-09-09通过分子涂层方法实现超级电容器
- 2024-09-09用于监测放射性气体排放的闪烁气凝胶
- 2024-09-09ChatGPT类数字病理学平台在癌症诊断领域展现出前景
- 2024-09-09通过表观遗传修饰将星形胶质细胞重新编程为脑干细胞
- 站长推荐
- 栏目推荐
