网站首页生活常识 >正文
当本·奥兰多(BenOrlando)在密歇根州立大学生物化学和分子生物学系发表2019年研究演讲时,它为数十年来的合作突破奠定了基础。
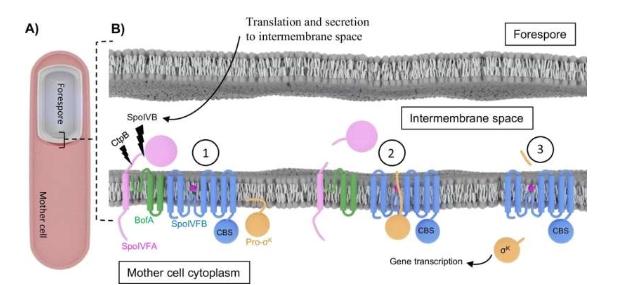
当天在演讲厅的嘉宾是名誉教授李·克罗斯(LeeKroos),他刚刚在今年9月从密歇根州立大学退休,结束了30多年的开创性职业生涯。克罗斯是细菌分子和遗传机制方面的专家,他长期与斯巴达同事合作,试图捕捉一种名为SpoIVFB的蛋白质的神秘结构。
SpoIVFB存在于模型细菌枯草芽孢杆菌中,属于一种称为膜内蛋白酶的特殊酶家族。这些酶有助于调节所有生命界的关键细胞功能。值得注意的是,SpoIVFB在孢子形成过程中起着关键作用——这一过程使细菌能够在辐射、高温甚至太空真空等恶劣条件下生存。
多年来,捕捉SpoIVFB结构的尝试面临着独特的挑战,Kroos很有兴趣了解奥兰多在尖端低温电子显微镜(cryo-EM)领域的专业知识。
“我认为本和我是志同道合的,”克罗斯说,当奥兰多于2020年夏天加入生物化学和分子生物学系(BMB)时,克罗斯主动联系了奥兰多,希望能够合作解决SpoIVFB的结构难题。“本非常乐观,我们能够在这件事上取得进展。”
现在,奥兰多和克罗斯研究小组在《自然通讯》上发表的一篇论文中报告了首个通过实验确定的高分辨率SpoIVFB结构。
具体来说,研究人员发现SpoIVFB与其底物结合。就像钥匙开锁一样,底物是酶与之相互作用的特定分子,有助于产生有用的生化产品。
这项研究深入了解了从细菌到人类等生物体中发现的细胞调控机制,对微生物学、结构生物学、酶学和人类疾病具有令人兴奋的意义。
这一突破也证明了密歇根州立大学先进的低温电子显微镜基础设施正在不断扩展,这使得斯巴达研究人员能够继续突破实验可行性的界限。
“过去几年,这项技术在膜蛋白结构生物学领域产生了革命性的影响,”奥兰多说道,他是密歇根州立大学招募的,参与了该校的全球影响力计划——这是一项全校范围的计划,旨在解决能源、卫生、教育和环境领域的重大挑战。“低温电子显微镜让我们能够窥视一个我们无法通过其他镜头看到的世界。”
生物学谜题的最后一块碎片
通过捕捉SpoIVFB与其底物的结构,研究人员拓宽了生物化学家对关键生物过程的理解。
蛋白酶通常通过蛋白水解分解或“裂解”蛋白质,这种反应需要水来切断氨基酸之间的肽键。然而,对于像SpoIVFB这样存在于细胞膜内的蛋白酶来说,这并非易事。
“回顾膜内蛋白酶(有人称之为‘膜内剪刀’)的发现,当时人们根本不知道这种情况会发生,”Kroos解释道。“膜的脂质双层是疏水的,所有蛋白酶都需要水来打破肽键。所以,最大的问题是:水是如何进入的?”
通过低温电子显微镜成像和分子动力学,Kroos和Orlando证实了SpoIVFB用于准备其切割底物的机制,以及水可能到达该位点的路线。
Orlando和Kroos确定的低温电子显微镜结构表明,SpoIVFB通过一种称为β片层增强的相互作用与底物结合。这一发现是一个巨大的生物学难题的最后一块拼图。从最简单的细菌到人类,生命界中发现了四类膜内蛋白酶。其中三种已知通过β片层增强与底物结合。
凭借最新的发现,密歇根州立大学团队终于证实了第四个发现。
奥兰多表示:“这些结构将β片层增强机制与所有四类膜内蛋白酶联系起来,作为生命界中共同的机制发挥作用,”他于2023年被授予JamesK.BillmanJr.医学博士特聘教授称号。
这些发现为结构生物学和人类健康贡献了重要知识。
膜内蛋白酶无法调节细胞功能与神经退行性疾病、癌症和代谢紊乱有关。
“有许多迹象表明,这些膜内蛋白酶也会影响重要致病菌的毒性,”Kroos补充道。“如果我们准确了解它们的结构,我们就可以设计出针对重要疾病的抗菌剂。”
对于Kroos来说,该团队的这一发现同样是其在BMB和微生物学、遗传学和免疫学系36年职业生涯的完美总结,最近有人发现Kroos在佩雷马凯特河上享受着飞钓的退休生活。
“过去几年,与本的合作非常棒,”克罗斯说。“我们就这项工作进行了精彩而深入的对话——这真是一个高调。”
从原子到生物
在对SpoIVFB进行多年表征的过程中,Kroos和BMB的同事们首先应用了一种称为X射线晶体学的方法。在此方法中,X射线照射结晶样品以产生衍射图,最终揭示出t3D分子结构。
然而,SpoIVFB晶体的质量和所需样品的数量一直是两个障碍。
“SpoIVFB对我们的结晶努力有很强的抵抗力,很难生产出大量有活性且可用的物质,”Kroos解释道。
奥兰多补充道:“诱导蛋白质聚结成晶体已经够有挑战性了。但当你开始谈论像SpoIVFB这样的膜蛋白时,情况就更加复杂了。”
在尝试结晶的过程中,Kroos团队与BMB的同事(例如MichaelGaravito、JianHu和MichaelFeig)合作,不断取得基础性发现,最终为解决SpoIVFB的结构铺平了道路。
通过他们最新的合作,低温电子显微镜让奥兰多和克罗斯绕过了X射线晶体学的一些最大瓶颈,并以前所未有的方式可视化了SpoIVFB。在单粒子电子显微镜中,电子束用于拍摄单个蛋白质分子的二维图像。然后利用这些二维图像生成目标蛋白质的三维图。
虽然这些电子可以提供许多材料的原子级分辨率图像,但它们也会损坏或破坏生物样本。这一障碍促成了低温电子显微镜的低温应用——这项创新获得了2017年诺贝尔化学奖。
为了对抗生物损伤,低温电子显微镜样本在一层薄薄的水缓冲液中制备,然后迅速浸入液态乙烷中,生成“玻璃状”冰。无需排列成晶格进行分析,单个粒子在冷冻时就被锁定在各种方向。
通过从不同角度拍摄样本的数千张甚至数百万张图像,研究人员能够创建正在成像样本的高度详细的3D地图。
“这项技术帮助我们越过了那座大山,随着它的进步,我们将越来越深入地探索生物学的新领域,”奥兰多说道,他期待密歇根州立大学低温电子显微镜设施的扩建将对从材料科学到微生物学和生物化学等一系列学科的研究人员意味着什么。
“我认为,像这样的地方的真正力量来自于我们校园里的人们,他们可以利用完全相同的技术及其广泛的规模。据我所知,这是我们可以观察一切(从原子到生物)的唯一方法,”奥兰多补充道。
版权说明:本站所有作品图文均由用户自行上传分享,仅供网友学习交流。若您的权利被侵害,请联系我们
相关文章:
- 2024-10-25热光伏技术展现出成本效益高的发电潜力
- 2024-10-25离子配对溶致发色液晶组装的新方法
- 2024-10-25新研究表明石蝇因人类活动而改变颜色
- 2024-10-23非本土植物是全球昆虫入侵的主要力量
- 2024-10-23未来的材料可以从废水中提取
- 2024-10-23雄蝇通过更激烈的争斗来弥补较短的眼柄
- 2024-10-23可穿戴设备用柔性热电纤维在极端环境下保持稳定的能量性能
- 2024-10-23入侵树木原木为蘑菇生产带来希望
- 2024-10-23研究发现当农田花蜜稀缺时花园可以防止传粉者挨饿
- 站长推荐
- 栏目推荐
