网站首页生活常识 >正文
虽然我们通常认为疾病是由异物(细菌或病毒)引起的,但影响人类的数百种疾病是由细胞蛋白质生产错误引起的。
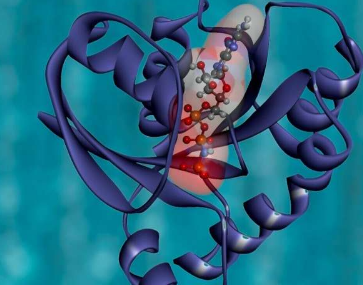
由马萨诸塞大学阿默斯特分校领导的一个研究小组利用尖端技术的力量,包括一种称为糖蛋白组学的创新技术,来解锁基于碳水化合物的代码,该代码控制某些类别的蛋白质如何将自身形成为保持其所需的复杂形状。我们健康。
这项发表在《分子细胞》杂志上的研究探索了丝氨酸蛋白酶抑制剂家族的成员,该家族与许多疾病有关。该研究首次调查了丝氨酸蛋白酶抑制剂上碳水化合物的位置和组成如何确保它们正确折叠。
当细胞对蛋白质折叠的监督出现问题时,可能会导致严重的疾病,从肺气肿、囊性纤维化到阿尔茨海默病。识别负责高保真折叠和质量控制的糖代码可能是针对许多疾病的药物治疗的一种有前途的方法。
科学家们曾经认为,控制生命的唯一密码是DNA,一切都由DNA的四个构建模块(A、C、G和T)如何组合和重组来控制。但近几十年来,人们已经清楚地认识到还有其他代码在起作用,特别是在构建复杂折叠的分泌蛋白方面,这些蛋白是在人类细胞的蛋白质工厂——内质网(ER)——一个膜封闭的隔室中产生的。蛋白质折叠开始。
大约7,000种不同的蛋白质(占人体所有蛋白质的三分之一)在内质网中成熟。分泌的蛋白质——统称为“分泌组”——负责从我们身体的酶到免疫和消化系统的一切,并且必须正确形成才能使人体正常运作。
称为“伴侣”的特殊分子有助于将蛋白质折叠成最终形状。它们还有助于识别折叠不完全正确的蛋白质,为它们的重新折叠提供额外的帮助,或者,如果它们无可救药地错误折叠,则在它们造成损害之前瞄准它们进行破坏。然而,作为细胞质量控制部门一部分的伴侣系统本身有时会出现故障,一旦出现故障,结果可能对我们的健康造成灾难性的影响。
ER中基于碳水化合物的伴侣系统的发现归功于麻省大学阿默斯特分校生物化学和分子生物学教授、该论文的资深作者之一DanielHebert在20世纪90年代作为博士后研究员发起的开创性工作。
“我们现在拥有的工具,包括麻省大学阿默斯特分校应用生命科学研究所的糖蛋白组学和质谱分析,使我们能够回答25年来一直悬而未决的问题,”赫伯特说。“这篇新论文的主要作者KevinGuay正在做我刚开始时只能梦想的事情。”
这些悬而未决的问题中最紧迫的一个是:分子伴侣如何知道7,000种不同的折纸样蛋白质何时正确折叠?
我们现在知道,答案涉及一种称为UGGT的“内质网守门人”酶,以及一系列称为N-聚糖的碳水化合物标签,这些标签与蛋白质氨基酸序列中的特定位点相连。
盖伊正在完成他的博士学位。在麻省大学阿默斯特分校的分子细胞生物学项目中,重点研究两种特定的哺乳动物蛋白质,即alpha-1抗胰蛋白酶和抗凝血酶。
他和他的合著者使用CRISPR编辑的细胞修改了ER伴侣网络,以确定N-聚糖的存在和位置如何影响蛋白质折叠。
他们观察了疾病变异被ER看门人UGGT识别,并且为了更仔细地观察,开发了许多创新的糖蛋白组学技术,使用质谱法来了解分布在蛋白质表面的聚糖发生了什么。
他们发现,UGGT酶用糖放置在特定位置来“标记”错误折叠的蛋白质。这是一种代码,陪伴人员可以读取它来准确确定折叠过程中出现问题的位置以及如何修复它。
Guay说:“这是我们第一次能够看到UGGT在人体细胞产生的蛋白质上添加糖的位置,以进行质量控制。”“我们现在有了一个平台,可以扩展我们对糖标签如何发送蛋白质进行进一步质量控制步骤的理解,我们的工作表明UGGT是靶向药物治疗研究的一个有前途的途径。”
麻省大学阿默斯特分校生物化学和分子生物学杰出教授、该论文的合著者之一LilaGierasch说:“这项研究的令人兴奋之处在于发现聚糖充当内质网中蛋白质折叠的代码。UGGT所发挥的作用的发现为未来理解和最终治疗由错误折叠蛋白质引起的数百种疾病打开了大门。”
版权说明:本站所有作品图文均由用户自行上传分享,仅供网友学习交流。若您的权利被侵害,请联系我们
相关文章:
- 2023-12-06研究有前景的异质结构增材制造的进展及其生物医学应用
- 2023-12-05新研究发现与其他灵长类动物相比新生儿的大脑并不发育不全
- 2023-12-05超轻超快酶同位素比以前想象的更强大
- 2023-12-05中子捕获研究提供了对天体物理学和探测器设计的见解
- 2023-12-05用于将纳米粒子放置在手掌中的3D模型
- 2023-12-05碰撞改变了聚变实验及其他实验中离子在等离子体波上冲浪的速度
- 2023-12-04旧石器时代的人类可能已经了解岩石的特性来制造石器
- 2023-12-04干旱数据显示全球范围内出现前所未有的紧急情况
- 2023-12-04在炎热的夏季和秋季之后迎接可能破纪录的冬季
- 站长推荐
- 栏目推荐
